Pile à combustible à hydrure de bore direct
Les piles à combustibles directes à hydrure de bore ou DBFC sont une sous-catégorie de piles à combustible alcalines dans lesquelles le combustible est une solution de borohydrure de sodium.

Catégories :
Pile à combustible - Propulsion alternative - Énergie renouvelable - Utilisation durable des ressources naturelles
|
Recherche sur Google Images :
Source image : fr.wikipedia.org Cette image est un résultat de recherche de Google Image. Elle est peut-être réduite par rapport à l'originale et/ou protégée par des droits d'auteur. |
Page(s) en rapport avec ce sujet :
- Le borohydrure de sodium, aussi nommé tétrahydruroborate de sodium, ... borohydrure de sodium est aussi utilisé dans des piles à combustible expérimentales (DBFC, acronyme de l'expression anglaise Direct Borohydride Fuel Cell) comme.... deux produits minéraux se forment aussi : l'hydroxyde de bore B (OH)... (source : educnet.education)
Les piles à combustibles directes à hydrure de bore ou DBFC (acronyme de l'expression anglaise Direct Borohydride Fuel Cell) sont une sous-catégorie de piles à combustible alcalines dans lesquelles le combustible est une solution de borohydrure de sodium.
Le borohydrure de sodium est parfois utilisé dans des piles à combustible expérimentales comme stockage d'hydrogène. Il est , comme combustible, moins inflammable et moins volatil que le pétrole, mais bien plus corrosif. Il est assez intéressant d'un point de vue environnemental, dans la mesure où il se dégrade rapidement en sels inertes quand il est rejeté dans la nature. L'hydrogène est alors généré pour une pile à combustible par une décomposition catalytique de la solution aqueuse de borohydrure, selon la réaction suivante : NaBH4 + 2 H2O → NaBO2 + 4 H2
Cependant, il est plus interessant d'oxyder ce combustible directement pour éviter la production d'hydrogène et , dans le même temps, augmenter un peu le rendement énergétique :
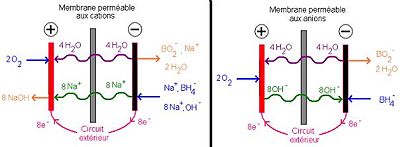
- à la cathode : 2 O2 + 4 H2O + 8 e- → 8 OH- E0 = 0, 4 V/ESH
- à l'anode : NaBH4 + 8 OH- → NaBO2 + 6 H2O + 8 e- E0 = -1, 24 V/ESH
La force électromotrice théorique est par conséquent de 1, 64 V.
Les DBFC pourraient être produites de manière moins onéreuse que les piles à combustible respectant les traditions, ne nécessitant pas de catalyseurs comme le platine, et produisent plus d'énergie par unité de volume que ces dernières. Cependant, les DBFC produisent de l'hydrogène à partir d'une réaction secondaire de NaBH4 avec de l'eau chauffée par la pile. Cet hydrogène peut être soit extrait directement par échappement ou dirigé vers une pile à combustible conventionnelle. Qui plus est , la pile à combustible produit de l'eau, qui peut être recyclée pour permettre des concentrations plus élevées en NaBH4.
Après avoir rejeté son hydrogène et avoir été oxydé, NaBO2 ou le borate est produit. Le borate est assez inerte et non toxique; c'est un détergent commun et un additif pour savons, quoiqu'il soit toxique pour les fourmis et forme par conséquent un des composants des poisons pour fourmis. Le borax produit peut être extrait vers un réservoir à déchets ou une poche souple dans la pile à combustible.
Le borate peut être ré-hydrogéné en combustible borohydrure au moyen de différentes techniques, certaines d'entre elles ne nécessitant rien qui plus est que de l'eau et de l'électricité ou de la chaleur. Ces techniques sont toujours en développement actif.
Remarques
Il existe deux types de DBFC qui ne changent que par la nature de leur électrolyte solide (travailler avec un électrolyte solide permet d'éviter au maximum la carbonatation de l'électrolyte). Ainsi, soit l'électrolyte est une membrane polymère échangeuse de cations, et le courant est transporté dans la membrane par des cations comme Na+; soit l'électrolyte est une membrane anionique et le courant est transporté dans celle-ci par les ions OH-.
Les membranes aujourd'hui les plus utilisées par les équipes de recherche sont des membranes protoniques, comme le nafion.
Stockage
L'utilisation d'un combustible permet un stockage plus facile que pour un combustible gazeux. Le borohydrure de sodium, d'énergie massique 9, 3 kWh. kg-1 (à comparer avec les 6, 3 kWh. kg-1), délivre une force électromotrice théorique de 1, 64 V, supérieure à la technologie concurrente de pile à combustible à méthanol direct (1, 21 V). Cependant, le temps de demie-vie du borohydrure de sodium (sous des conditions d'acidité pH = 14) est de l'ordre de 180 jours, ce qui peut s'avérer problématique pour des applications à longs termes.
Fonctionnement en milieu alcalin
Le fonctionnement en milieu alcalin (basique) offre deux avantages à la technologie DBFC :
- l'utilisation envisageable de catalyseurs non nobles (à l'inverse du palladium, par exemple), donnant la possibilité ainsi de diminuer les coûts.
- une meilleure cinétique de la réaction électrochimique comparé à un milieu acide.
Inconvénients
Hydrolyse des borohydrures
En pratique, il existe un problème anodique de compétition entre l'oxydation directe des borohydrures et leur hydrolyse, selon la réaction suivante :
Cette réaction parasite, quoique défavorisée cinétiquement en milieu alcalin, est catalysée par la majorité des catalyseurs utilisés pour l'oxydation des borohydrures, diminuant ainsi la puissance et limitant l'efficacité énergétique du dispositif.
«Cross-over» dans les piles à combustibles liquides
Le phénomène de «cross-over», qui comprend de manière habituelle deux composantes : la diffusion et l'électro-osmose, forme l'un des problèmes majeurs des piles à combustibles à alimentation liquide. Pour la DBFC, ce phénomène est moindre théoriquement que pour la DMFC : en effet, l'électro-osmose, qui est définie comme un flux d'ions OH- ou d'ions H+ solvaté par l'eau ou par le combustible, ne se produit pas dans les piles DBFC, les hydroxydes se déplacent de la cathode vers l'anode, et qu'il n'y a par conséquent pas de flux de combustible.
Verrous technologiques
La DBFC possède un nombre important de barrières technologiques à résoudre avant une envisageable commercialisation :
- Il n'existe pas (pour l'instant) d'ionomère anionique commercial en solution. Or, pour pouvoir récupérer l'électricité produite par les réactions électrochimiques, il est indispensable d'avoir un maximum de zones catalytiques donnant la possibilité en même temps la conduction ionique et électronique. Si à l'anode la solution basique de combustible sert à conduire efficacement les ions dans tout le volume de la couche active, à la cathode les ions ne sont présents qu'à l'interface intime avec la membrane ce qui réduit énormément la surface active dans la mesure où il n'y a plus de notion d'électrode volumique.
- La réaction d'hydrolyse est importante et ne permet pas une utilisation maximale du combustible, l'efficacité énergétique du dispositif en est par conséquent pénalisée.
- Il y a apparition de borohydrures (et/ou d'autres produits) à la cathode liée à un phénomène de cross-over non maîtrisé. L'étude et le développement de catalyseurs cathodiques non perturbés en présence de borohydrures sont par conséquent nécessaires. Un travail sur la membrane est aussi indispensable pour limiter le cross-over.
Sur le combustible
Les borates produits sont assez inertes et non toxiques pour les hommes (mais pas pour les fourmis). Ils sont couramments utilisés comme détergents et additifs pour les savons. Les borates peuvent être ré-hydrogénés en NaBH4 par différentes techniques, dont certaines ne nécessitent comme apport que de l'eau et de l'énergie sous forme électrique ou thermique. Ces techniques sont toujours en développement.
Le borohydrure de sodium coûte aujourd'hui à peu près 50 /kg (40€/kg à peu près), mais en procédant au recyclage du borax ainsi qu'à une production de masse, les coûts descendraient certainement vers 1 /kg (0, 8 €/kg).
Références
- (en) The Direct Sodium Borohydride Fuel Cell for Unmanned Underwater Vehicle Application (pdf)
- (en) MERIT reseach on DBFC
- (en) Cet article est partiellement ou en totalité issu d'une traduction de l'article de Wikipédia en anglais intitulé «Direct borohydride fuel cell».
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 29/03/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.
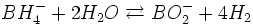

 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité